在过去的9月份,食品安全标准与监测评估司官网发布了GB 4789.35-2023《食品安全国家标准 食品微生物学检验乳酸菌检验》等85项食品安全国家标准和3项修改单的公告。
据悉,新标准将代替GB4789.35-2016《食品安全国家标准 食品微生物学检验乳酸菌检验》,并于明年3月6日起正式实施。
-1024x574.jpg)
与2016版标准相比,2023版新标准主要变化如下▼:
☛ 增加了实时荧光PCR方法为选做方法
☛ 修改了乳酸菌的定义、样品制备、培养时间
☛ 修改了嗜热链球菌和乳杆菌计数方法的描述
☛ 修改了部分培养基成分、储备液浓度和制备方法
往下滑☟逗点生物为您总结主要变化
一、范围
本标准规定了含乳酸菌食品中乳酸菌(lactic acid bacteria)的检验方法。
本标准适用于含活性乳酸菌的食品中乳酸菌的检验。
【无变化】
2014年8月6日国家卫生和计划生育委员会公布的《可用于食品的菌种名单》中,还有乳球菌属和片球菌属。现在不少乳品生产企业在发酵乳产品中添加了这些球菌。因此,进行发酵乳制品的乳酸菌检验时,无法避免这两类球菌造成的干扰。
二、术语和定义
2.1 乳酸菌lactic acid bacteria
一类可发酵糖主要产生大量乳酸的细菌的通称,不能液化明胶、不产生咧喋、革兰氏阳性、无运动、无芽孢、触酶阴性、硝酸还原酶阴性及细胞色素氧化酶阴性反应的细菌。本标准中乳酸菌主要为乳杆菌属(Lactobacillus),双歧杆菌属(Bif idobacterium)和嗜热链球菌(Streptococcus thermophilus)。
【变化解析】
修改了乳酸菌的定义,增加其生化现象的描述。
三、设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:
3.1 恒温培养箱:36℃士1 ℃。
3.2 厌氧培养装置:厌氧培养箱﹑厌氧罐、厌氧袋或能提供同等厌氧效果的装置。
3.3 冰箱:2℃~8 ℃。(范围扩大)
3.4 均质器及无菌均质袋,均质杯或灭菌乳钵。
3.5 涡旋混匀仪。
3.6 电子天平:感量0.001 g。(精度升高)
3.7 实时定量PCR仪。
3.8 恒温水浴锅或金属浴。
3.9 离心机:离心力≥>10 000×g。
3.10 无菌试管:18 mm×180 mm,15 mm×100 mm。
3.11 无菌吸管: l mL(具 0.0l mL刻度)、10 mL(具 0.1 mI刻度)。
3.12 微量移液器和灭菌吸头 :2 pL、10 u.L.100 pL200 p.L 1 000 uL。
3.13 无菌锥形瓶:500 mL,250 mL。
3.14 无菌平皿:直径90 mm。
3.15 PCR管。
【变化解析】
1.增加设备:厌氧装置、涡旋混匀仪、实时定量PCR仪、恒温水浴锅或金属浴、离心机、微量移液器和灭菌吸头、无菌平皿、PCR管等;
2.电子天平精度由0.01g改为0.001g;主要是为了保证对于那些活菌菌种制品的称量准确性;
3.冰箱温度范围由2℃~5 ℃改为2℃~8 ℃。

SDC-3000-D
多管旋涡混匀仪
TC65
便携式恒温培养箱
四、培养基和试剂
4.1 稀释液:见附录A中 A.1。(新增)
4.2 MRS(Man Rogosa Sharpe)琼脂培养基:见附录A中A.2。
4.3 莫匹罗星锂盐(Li Mupirocin)和半胱氨酸盐酸盐(Cysteine Hlydrochloride)改良MRS琼脂培养基:见附录A中A.3。
4.4 MC培养落( Modified Chalmers 培养基):见附录A中A.4。
4.5 0.5%蔗糖发酵管:见附录A中A.5。
4.6 0.5%纤维二糖发酵管:见附录A中A.5。
4.7 0.5%麦芽糖发酵管:见附录A中A.5。
4.8 0.5%甘露醇发酵管:见附录A中A.5。
4.9 0.5%水杨苷发酵管:见附录A中A.5。
4.10 0.5%山梨醇发酵管:见附录A中A.5。
4.11 0.5%乳糖发酵管:见附录A中A.5。
4.12 七叶苷发酵管:见附录A中A.6。
4.13 革兰氏染色液:见附录A中A.7。
4.14 生理盐水:见附录A 中A.8。
4.15 DNA提取液:见附录A中 A.9。(新增)
4.16 10XPCR缓冲液:见附录A中 A.10。(新增)
4.17 莫匹罗星锂盐(C26HIx;O,- Li):化学纯。
4.18 半胱氨酸盐酸盐(C: I1;ClNO,S):纯度99 %。
4.19 dNTPs。(新增)
4.20 Taq DNA聚合酶:5 U/ pL。(新增)
4.21 七种乳酸菌引物探针。(新增)
4.22 灭菌去离子水。(新增)
【变化解析】
增加培养基:稀释液;这样尽可能避免减少乳酸菌复苏数量;
实时荧光PCR检测用试剂:DNA提取液、10XPCR缓冲液、dNTPs、Taq DNA聚合酶、七种乳酸菌引物探针、灭菌去离子水等;
五、检验程序
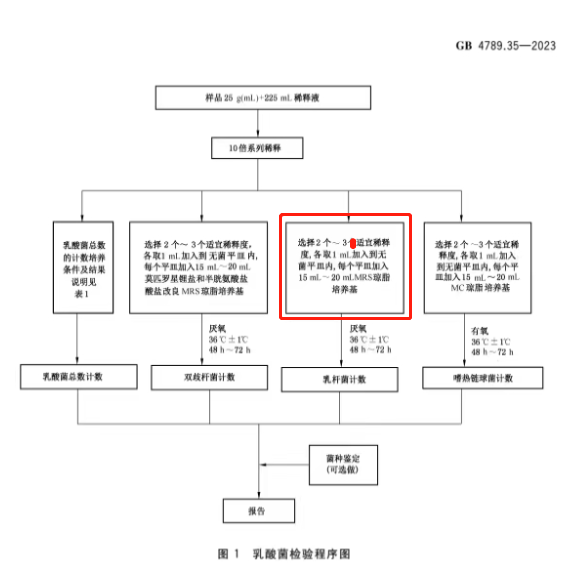
【变化解析】
检验程序主要修改点为增加乳杆菌计数。
六、操作步骤
6.1 样品制备
6.1.1 样品的全部制备过程均应遵循无菌操作程序。
6.1.2 稀释液在试验前应在36℃士1 ℃条件下充分预热15 min~30 min。
6.1.3 冷冻样品可先使其在2℃~5℃条件下解冻,时间不超过18h,也可在温度不超过45℃的条件解冻,时间不超过15min。
6.1.4 固体和半固体样品:以无菌操作称取25g样品,置于装有225 mL稀释液的无菌均质杯内,于8 000×g ~10 000×g 均质l min~2 min,制成1∶10样品匀液;或置于225 mL稀释液的无菌均质袋中,用拍击式均质器拍打l min~-2 min制成l∶10 的样品匀液。
6.1.5 液体样品:液体样品应先将其充分摇匀后以无菌吸管吸取样品25 mL放入装有225 mL稀释液的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)或均质袋中,充分振摇或拍击式均质器拍打l min~2 min,制成1 ∶10的样品匀液。
6.1.6 经特殊技术(如包埋技术)处理的含乳酸菌食品样品应在相应技术/工艺要求下进行有效前处理。

该装置可以有效地分离被包含在固体样品内部和表面的微生物样品,确保无菌袋中混合的样品具有充分的代表性。
【变化解析】
1.增加稀释液预热的操作;
2.增加特除技术处理的乳酸菌食品样品的前处理要求;
3.液体样品处理增加拍打均质器的操作。
6.2 稀释及培养
6.2.1 用l mL无菌吸管或微量移液器吸取1∶10样品匀液l mL,沿管壁缓慢注于装有9 mL稀释液的无菌试管巾(注意吸管或微量移液器吸头尖端不要触及稀释液),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1∶100 的样品匀液。
6.2.2 另取l mL无菌吸管或微量移液器吸头,按上述操作顺序,做10倍递增样品匀液,每递增稀释一次,即换用1次l mL灭菌吸管或吸头。
6.2.3 经特殊技术(如包埋技术)处理的含乳酸菌食品应按照相应技术/工艺要求进行稀释。(新增)
6.3乳酸菌计数
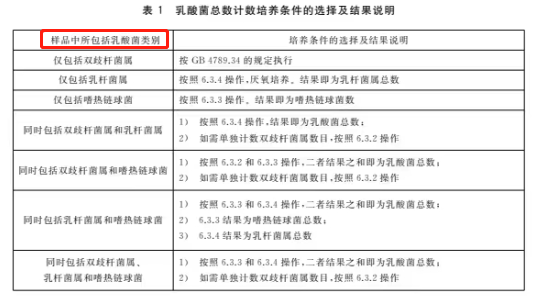
6.3.1 乳酸菌总数
乳酸菌总数计数培养条件的选择及结果说明见表1。
6.3.2 双歧杆菌计数
根据对待检样品双歧杆菌含量的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1mL样品匀液于灭菌平皿内,每个稀释度做两个平皿。稀释液移入平皿后,将冷却至48 ℃~50 ℃的莫匹罗星锂盐和半胱氨酸盐酸盐改良MRS琼脂培养基倾注入平皿15 mL~20 mL,转动平皿使混合均匀。培养基凝固后倒置于36 ℃士1℃厌氧培养,根据双歧杆菌生长特性,一般选择培养48 h,若菌落无生长或生长较小可选择培养至72 h,培养后计数平板上的所有菌落数。从样品稀释到平板倾注要求在15 min内完成。
6.3.3嗜热链球菌计数
根据待检样品嗜热链球菌活菌数的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1mL样品匀液于灭菌平皿内,每个稀释度做两个平皿。稀释液移入平皿后,将冷却至48℃~50 ℃的MC琼脂培养基及时倾注入平皿15 mL~20 mL,转动平皿使混合均匀。培养基凝固后倒置于36 ℃土1℃有氧培养,根据嗜热链球菌生长特性,一般选择培养48 h,若菌落无生长或生长较小可选择培养至72 h。嗜热链球菌在MC琼脂培养基平板上的菌落特征为:菌落中等偏小,边缘整齐光滑的红色菌落,直径2 mm士l mm,菌落背面为粉红色。从样品稀释到平板倾注要求在15 min内完成。
6.3.4 乳杆菌计数
根据待检样品活菌总数的估计,选择2个~3个连续的适宜稀释度,每个稀释度吸取1 mL样品匀液于灭菌平皿内,每个稀释度做两个平皿。稀释液移入平皿后,将冷却至48 ℃~50 ℃的MRS琼脂培养基倾注入平皿15 mL~20 mL,转动平皿使混合均匀。培养基凝固后倒置于36℃士1℃厌氧培养,根据乳杆菌生长特性,一般选择培养48 h,若菌落无生长或生长较小可选择培养至72 h。从样品稀释到平板倾注要求在15 min内完成。
【变化解析】
1.修改了文字描述;
2.培养基温度和倾注的培养基的量均改为了一定的范围;
3.培养时间根据培养生长特性可以培养48h至72 h。
6.4菌落计数
见GB 4789.2菌落计数部分。
6.5结果的表述
见GB 4789.2计算方法部分。
6.6菌落数的报告
见 GB 4789.2菌落总数的报告部分。
七、结果与报告
根据菌落计数结果出具报告,报告单位以CFU/g(mL)表示。
八、乳酸菌的鉴定(可选做)
8.1 第一法 生化鉴定
8.1.纯培养
挑取3个或以上单菌落,嗜热链球菌接种于MC琼脂平板,置36℃士1℃有氧培养48 h,乳杆菌属接种于MRS琼脂平板,置36℃士1℃厌氧培养48 h。
8.1.2 双歧杆菌的鉴定
按GB 4789.34的规定操作。
8.1.3 涂片镜检:
嗜热链球菌菌体镜下呈球形或球杆状,直径为0.5 um~2.0 um,成对或成链排列,无芽孢,革兰氏染色阳性。乳杆菌属镜下菌体形态多样,呈长杆状.弯曲杆状或短杆状,无芽孢,革兰氏染色阳性。
【变化解析】
修改了文字描述,强调形态是在镜下的;
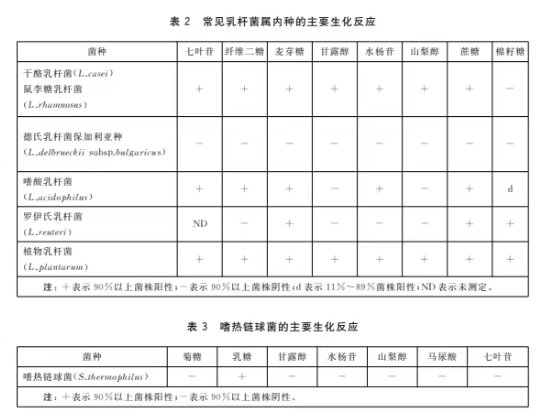
8.1.4 乳酸菌种主要生化反应
乳酸菌种主要生化反应见表2和表3。
8.2 、第二法实时荧光PCR法鉴定
8.2.1纯培养
同8.1.1。
8.2.2DNA模板制备
使用接种环刮取 MC琼脂平板或MRS琼脂平板上的菌落2个~10个,悬浮于200uL灭菌生理盐水中,充分混匀,10 000×g ~12 000×g 离心3 min,弃去上清。加入50uLDNA提取液涡旋混匀,置于100℃水浴或者金属浴中10 min后迅速冷却,10 000×g~12 000×g离心3 min。吸取上清液至新的PCR反应管内,作为DNA模板使用。提取后的DNA模板应置于4℃供当天使用,否则应于-20℃以下保存,并于1周内使用。
注:根据实验室实际情况﹐也可用商品化试剂盒制备DNA模板。
8.2.3 PCR反应体系
总反应体系体积为25 uL:10× PCR缓冲液2.5 uL、上下游引物(10 umol/L)各l uL、探针(10 umol/L)0.5 pL,dNTPs(2.5 umol /L)3uL、Taq DNA聚合酶(5 U/uL)0.5uL,模板DNA 1uL、灭菌去离子水补足至25uL。每个反应均应设置至少2个平行。
注:反应体系中各试剂的量可根据具体情况或不同的反应总休积进行适当调整。亦可选用含有PCR级冲液、MgCl2 ,dNTP和Taq酶等成分基于Taqman探针的实时荧光PCR预混液。
8.2.4 PCR反应条件
50 ℃ 5 min,95℃预变性3 min,94 ℃变性5s,60 ℃退火延伸40 s(同时收集FAM荧光),进行40个循环。
注:PCR反应参数可根据基因扩增仪型号实时荧光PCR反应体系进行适当调整。
鉴定用引物和探针序列见表4。
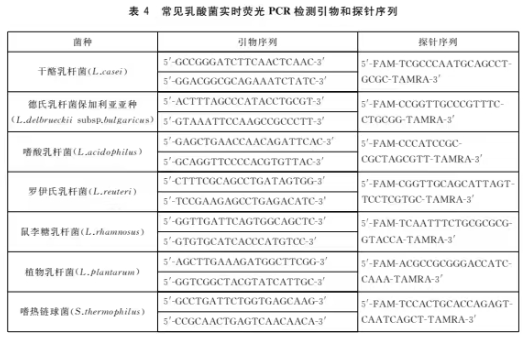
8.2.5对照设置
检测过程(包括DNA提取)中,每个反应均应设置阳性对照、阴性对照和空白对照。其中阳性对照模板为扩增片段的阳性克隆分子DNA或阳性菌株 DNA,阴性对照模板为非乳酸菌菌株 DNA,空白对照模板为无菌水。
8.2.6结果判读
8.2.6.1对照的结果判读
阳性对照出现典型扩增曲线,Ct≤30;阴性对照无典型扩增曲线或Ct≥40;空白对照无典型扩增曲线或Ct≥40。否则,结果视为无效。
8.2.6.2样品的结果判读
当样品检测Ct≥40时,判定样品结果为某种乳酸菌阴性;当检测Ct≤35,可判定该样品结果为某种乳酸菌阳性;当检测35<ct<40时,重复试验,若重复试验结果检测ct≥40,则判定为某种乳酸菌阴性,否则,判定为某种乳酸菌阳性。< span=””></ct<40时,重复试验,若重复试验结果检测ct≥40,则判定为某种乳酸菌阴性,否则,判定为某种乳酸菌阳性。




【写在最后】
AIculture慧养®是逗点生物旗下品牌,专注于微生物培养基的研发和生产,致力于为微生物检测提供高效、便捷的系统化整体解决方案。如您正从事相关行业,可通过400-878-7248联系我们~

