在《GB 5009.31-2025 食品安全国家标准食品中对羟基苯甲酸酸酯类化合物的测定》标准更新中,果酱基质中对羟基苯甲酸酯类化合物的测定前处理及色谱分析方法也做了很大的改变,目前也收到很多实验室老师反馈果酱基质的结果不太理想,并且上样速度较慢。针对这一反馈,逗点生物技术团队选取了草莓果酱基质,通过Copure®MAX 小柱净化,经过多番论证和实验前处理过程的优化,草莓果酱基质的7种对羟基苯甲酸酯回收率均能满足标准要求,并且能有效改善果酱基质样液的净化时间。
样品前处理
1.样品提取
称取均匀草莓果酱试样5g于50mL刻度离心管中,加入1mL浓氨水和4mL水,涡旋3min,放置1h;加入甲醇10mL,涡旋3min,超声20min,8000r/min 离心3min,;取全部上清液于另一50mL刻度离心管中,残渣中再加入甲醇-水(2+8)10mL重复提取1次,合并两次提取液,加水至40mL,8000r/min离心3min,取全部上清液,待净化。
注:(1)高浓度加标时,加标体积容易过大,提取时加入甲醇的量应扣除掉加标标准溶液中甲醇的量。
(2)果酱基质中含有较多果胶、多糖和有机酸,标准中加入5mL浓氨水,,氨水浓度太高的情况下,果酱中的果胶和多糖会发生皂化和水解,使得样液粘度变大易造成MAX 小柱发生堵塞。实验室优化氨水浓度后,上样液pH值10~11之间(标准条件下的待净化液pH值在11~12左右),在既能中和果酱中的有机酸的前提下,同时降低了样液的粘稠度,使得后续净化过程更加顺利。
2. 净化(Copure®MAX,500mg,6mL)
活化:分别用5mL甲醇、5mL水溶液活化小柱;
上样:将上述待净化液全部转移至已活化的小柱中;
淋洗:依次用5mL水、5mL甲醇-水溶液(3+7)淋洗小柱;
洗脱:加入6mL2%甲酸甲醇洗脱,压干小柱,收集洗脱液于试管中,加水定容至10mL,涡旋混匀,过亲水PTFE滤膜,上机测试。
3.标准系列工作液
吸取适量中间液,用甲醇-水溶液(3+7)溶液逐级稀释,得到浓度为0.5μg/mL、1μg/mL、5μg/mL、10μg/mL、20μg/mL、50μg/mL的混合标准工作液。
仪器条件
1.仪器条件
吸取适量中间液,用甲醇-水溶液(3+7)溶液逐级稀释,得到浓度为0.5μg/mL、1μg/mL、5μg/mL、10μg/mL、20μg/mL、50μg/mL的混合标准工作液。
仪器:液相色谱仪,ThermoFisher U3000
色谱柱:Commasil® C18(150×4.6mm,3μm)
流动相:A:乙腈,B:0.1%磷酸水溶液;
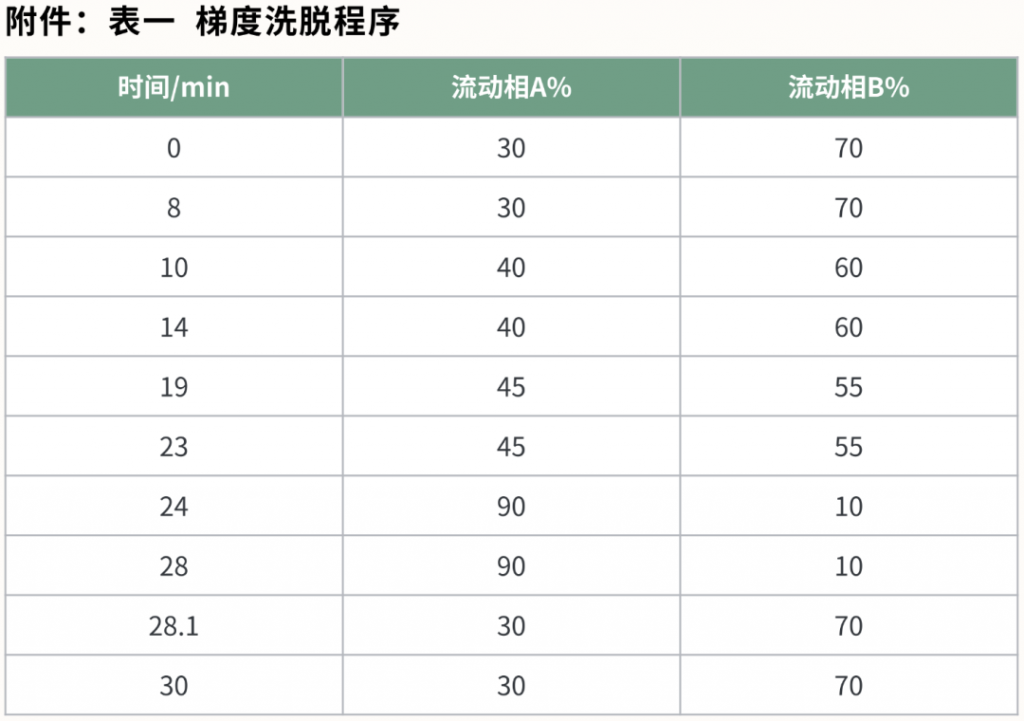
梯度洗脱程序:见下图表1
柱温:35℃
流速:0.7mL/min
检测波长:254nm
进样量:10μL
实验结果
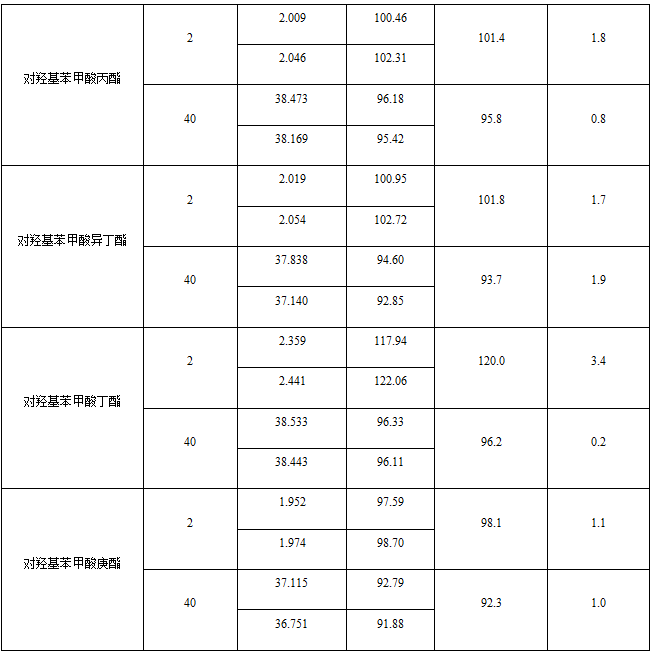
1.样品加标结果表
附件:表二 样品加标结果表

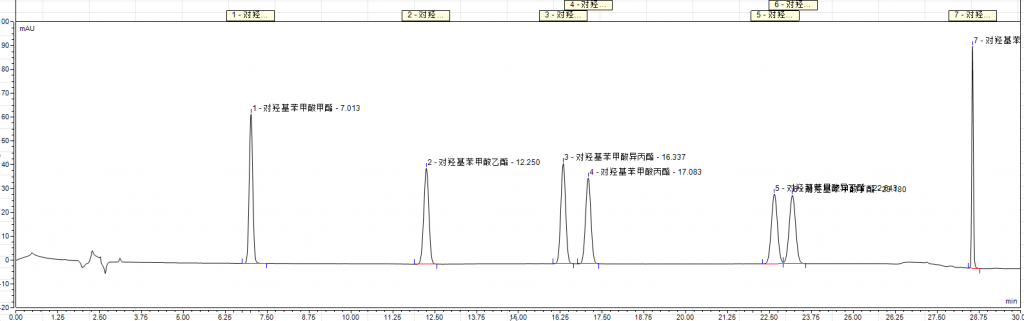
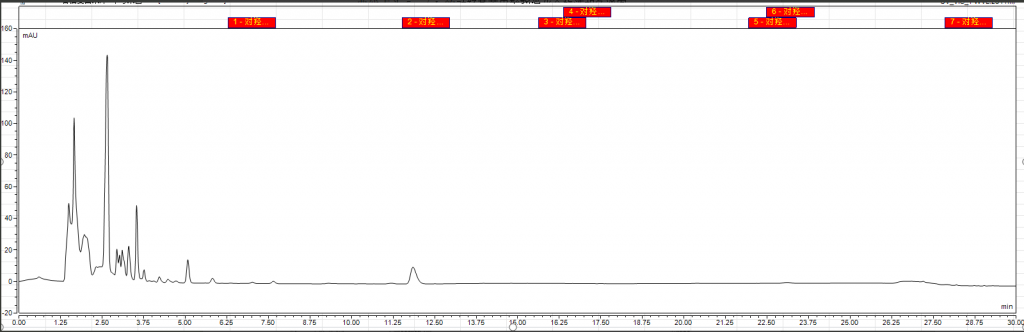
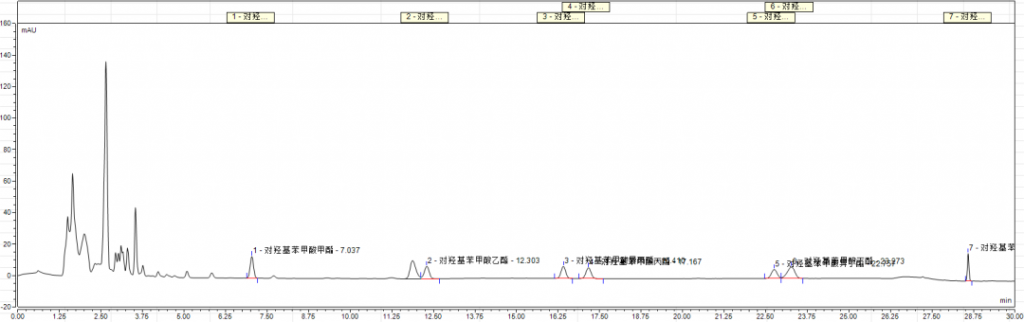
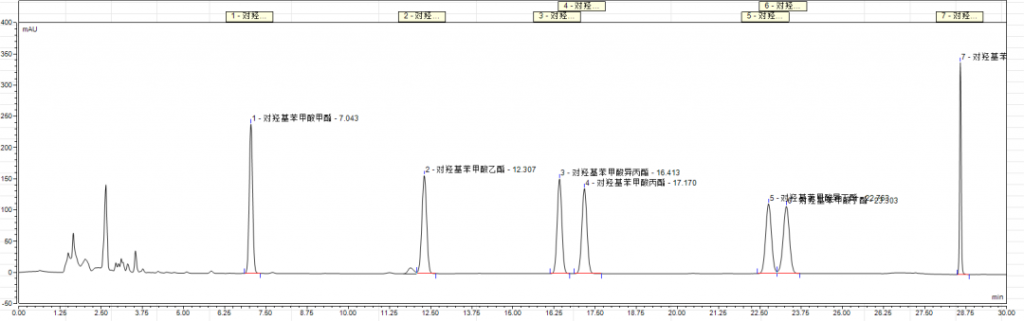
2.相关谱图参考
附件:实验相关图谱
订货信息