
根据《医疗机构新型冠状病毒核酸检测工作手册(试行第二版)》通知,“人群筛查应选择具有病毒灭活功能,如含胍盐(异硫氰酸胍或盐酸胍等)或表面活性剂的采样管。
灭活型病毒采样管可高效灭活病毒,保护病毒核酸不被降解,且能在常温下保存较长时间,为样品保存及运输节省成本。选择灭活效果好的病毒采样管,有助于确保后续核酸检测质量。
本期实验,我们选取逗邦®一次性使用病毒采样管进行灭活效果测试,过程如下:
实验材料:
病毒采样管:
逗邦®一次性使用病毒采样管(灭活型)
实验材料:
慢病毒(吉凯基因,GCNL0319432),HEK293T细胞
核酸提取试剂盒和提取仪:
逗邦®(BNP027-2B, M32)
新冠荧光PCR试剂盒:
圣湘(N083-5X0001)
实验方法:
参考《消毒技术规范》(2002版)病毒灭活试验中描述的检测方法,确定病毒保存管灭活能力。
步骤一:细胞培养
将生长状态良好的HEK293T细胞消化计数后稀释至1×104/mL,按照100μL/孔的体积,每个梯度的病毒做三个复孔,计算所需接种孔数,将细胞缓慢均匀接种至96孔板中。放入37℃,5%CO2培养箱中培养过夜。
步骤二:慢病毒稀释
将病毒滴度为107-108TU/mL的慢病毒按10倍梯度进行稀释,连续稀释3个梯度。
步骤三:病毒灭活
把稀释好的病毒置于室温条件下,与灭活款病毒保存液(批号:220201/220207/220211)按1:1体积比进行混合,置于室温下分别放置1min、5min和10 min进行灭活。
步骤四:终止灭活
采用病毒分离培养基(可用DMEM完全培养基替代)进行1000倍稀释以中和灭活保存液,终止灭活。
阴性对照:为病毒分离培养基对灭活款病毒保存液稀释1000倍的混合液;
阳性对照:为病毒分离培养基对病毒原液稀释1000倍的混合液。
步骤五:病毒孵育
将事先培养的HEK293T细胞中吸弃细胞培养基,每孔加入100μL准备好的病毒混合液,和对应的阳性对照、阴性对照。病毒孵育3小时,每隔30分钟从培养箱中取出晃动一次。
步骤六:细胞培养
孵育结束后,将病毒液吸去,每孔中加入100μL DMEM完全培养基,将96孔板置于37℃,5% CO2培养箱中培养,并观察细胞状态。
步骤七:荧光细胞观察与计数
继续培养48-72h,期间观察细胞状态,若细胞培养液变黄,应换液,对荧光细胞个数适量的孔进行计数,计算病毒滴度。
实验结果:
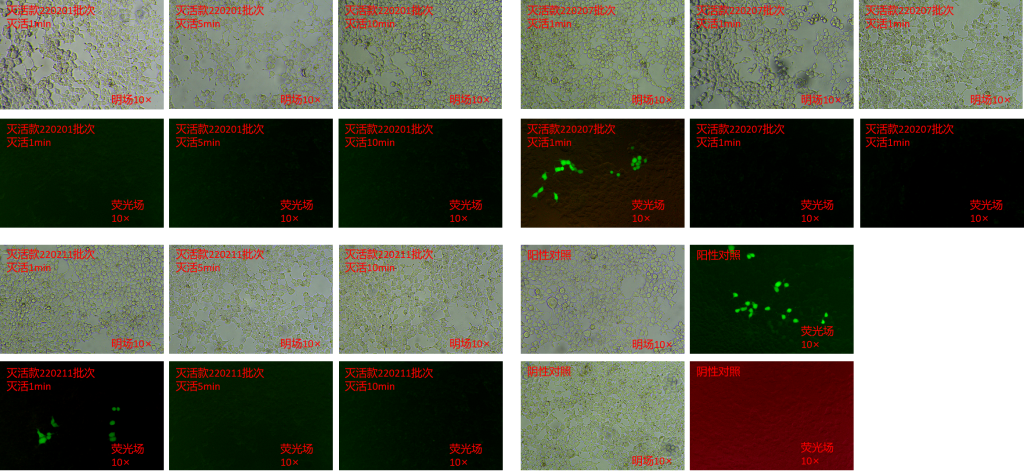
不同时间后细胞生长情况

不同时间后病毒滴度情况
实验结论:
由图1和表1数据可以看出,慢病毒经灭活1min、5min和10min后感染HEK293T细胞后,在显微镜明场下细胞生长正常;三批次的灭活款病毒保存管与病毒作用5min后,可以有效灭活病毒。
